Rumus Termokimia – Termokimia merupakan ilmu tentang perubahan kalor (panas) suatu zat yang melibatkan proses kimia dan fisika.
Termokimia yang merupakan bagian dari Termodinamika membahas tentang perubahan energi yang menyertai suatu reaksi kimia yang dimanifestasikan sebagai kalor reaksi.
Partikel-partikel penyusun zat selalu bergerak konstan, sehingga zat memiliki energi kinetik. Energi kinetik rata-rata suatu objek berbanding lurus dengan temperature absolutnya (0K).
Ini berarti jika suatu objek dalam keadaan panas, atom-atom molekulnya-molekul penyusun objek tersebut bergerak cepat, sehingga energy kinetic objek tersebut besar.
Energi potensial suatu zat muncul dari gaya tarik menarik dan tolak-menolak antara partikel-partikel penyusun zat. Salah satu bentuk energi yang umum dijumpai adalah energi kalor.
Kalor merupakan salah satu bentuk energi yang dapat dipertukarkan antara sistem dan lingkungan. Kalor reaksi adalah perubahan energi dalam reaksi kimia dalam bentuk kalor.
Secara umum untuk mendeteksi adanya kalor yang dimiliki oleh suatu benda yaitu dengan mengukur suhu benda tersebut. Jika suhunya tinggi maka kalor yang dikandung oleh benda sangat besar, begitu juga sebaliknya jika suhunya rendah maka kalor yang dikandung sedikit.
Alat untuk mengukur kalor reaksi dari suatu reaksi kimia adalah kalorimeter. Kalorimeter yang menggunakan teknik pencampuran dua zat didalam suatu wadah, umumnya digunakan untuk menentukan kalor jenis suatu zat.
Ada dua jenis kalorimeter yaitu kalorimeter volume tetap dan kalorimeter tekanan tetap. Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor yang dilepaskan saat pembakaran sempurna.
Sedangkan, kalorimeter sederhana dapat dibuat dari wadah atau gelas yang sifatnya isolator (tidak menghantarkan panas).
Rumus kalorimeter bom :
qreaksi = – (qkalorimeter + qair)
qkalorimeter = Ckalorimeter x ∆T
Keterangan: Ckalorimeter = kapasitas kalor pada kalorimeter (J°C-1 atau JK-1), dan ∆T = perubahan suhu (°C atau K).
Rumus kalorimeter sederhana :
qreaksi = – (qkalorimeter + qlarutan)
atau
qreaksi = – qlarutan
qreaksi = m x c x ∆T
Keterangan: q = kalor reaksi (J atau KJ), m = massa (g atau kg), c = kalor jenis (J/g°C atau K/kg K), dan ∆T = perubahan suhu (°C atau K).
Rumus Termokimia Kelas 11
Termokimia melibatkan suatu reaksi kimia, tentu saja kalau ada reaksi kimia berarti ada “reaktan” dan “produk/hasil”.
Kalian lihat pada reaksi yang terjadi antara gas metana (CH4) dan molekul oksigen (O2), kemudian akan menghasilkan produk berupa gas karbon dioksida (CO2) dan air (H2O).
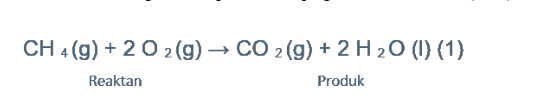
Pada reaksi tersebut, bisa Kalian lihat bahwa bahan bakar bergabung dengan oksigen untuk menghasilkan air dan karbon dioksida.
Reaksi itu disebut dengan reaksi pembakaran. Kemudian, ketika bahan bakar (pada reaksi di atas adalah metana) diharapkan dapat melepas panas, maka disebut dengan reaksi eksoterm. Sebaliknya, reaksi yang menyerap panas disebut dengan reaksi endoterm.
Rumus Termokimia Perubahan Entalpi
Perubahan termokimia erat kaitannya dengan istilah “sistem” dan “lingkungan”. Di mana sistem dianggap sebagai reaktan dan produknya, sedangkan lingkungan adalah segala sesuatu yang di luar reaktan dan produknya.
entalpi merupaka besar energi kimia yang dimiliki suatu zat pada tekanan tetap. Jika elo ditanya seperti ini, “jelaskan bagaimana hukum kekekalan energi dengan entalpi”, maka sejatinya entalpi tidak akan berubah apabila tidak ada energi yang diserap ataupun dilepaskan.
Entalpi dinyatakan dengan huruf H (heat content), dengan satuannya yaitu Joule. Rumus perubahan entalpi (∆H) adalah sebagai beriku :
∆H = Hproduk – Hreaktan
Dengan catatan sebagai berikut :
1) Bila ∆H positif, berarti terdapat energi/kalor yang diserap dari lingkungan ke dalam sistem (reaksi endoterm).
2) Sebaliknya, bila ∆H bernilai negatif, berarti terdapat energi/kalor yang dilepas oleh sistem ke lingkungan (reaksi eksoterm).
Ciri-ciri reaksi endoterm yaitu terjadi penurunan suhu yang menyebabkan suhu lingkungan menjadi dingin.
Sedangkan, ciri-ciri dari reaksi eksoterm adalah terjadi kenaikan suhu, sehingga suhu lingkungan menjadi panas.
Persamaan termokimia adalah persamaan reaksi kimia yang dilengkapi dengan besar perubahan entalpinya (∆H). Satuan yang dipakai untuk menyatakan ∆H adalah kJ (kiloJoule) atau kkal (kilokalori).
Nah, itulah informasi mengenai Rumus Termokimia yang bisa kami bagikan. Semoga bermanfaat dan terima kasih telah membaca.