Teori struktur atom merupakan salah satu konsep ilmiah tertua mengatakan bahwa semua materi dapat dipecah menjadi zarah (partikel) terkecil hingga partikel-partikel ini tidak dapat terbagi lagi.
Bagian terkecil dari suatu benda ini disebut dengan atom. Istilah atom diberikan oleh Demokritus pada 400 SM yang diambil dari bahasa Yunani yang berarti tidak terbagi, (A= tidak, tomos = terbagi).
Pendapat Demokritus tersebut dibantah oleh Aristoteles yang juga seorang filsuf Yunani. Aristoteles menyatakan bahwa suatu zat tersusun atas api, air, tanah, dan udara. Teori Aristoteles kemudian digunakan selama berabad-abad.
Hingga pada 1803, John Dalton mengemukakan pemikirannya tentang dasar teori struktur atom. Menurut model atom Dalton, atom digambarkan sebagai bola pejal yang sangat kecil, bersifat identik dan tidak bermuatan.
Teori struktur atom Dalton bertahan hingga 1896, hingga penelitiannya dipatahkan oleh J.J. Thomson, Ernest Rutherford, Robert Millikan, dan James Chadwick. Model atom Thomson mengilustrasikan struktur atom seperti roti kismis karena atom merupakan bola padat bermuatan positif dengan partikel negatif (elektron) yang berjumlah sama tersebar di dalamnya.
Sedangkan teori struktur atom Rutherford menyatakan, setiap atom mengandung inti atom yang bermuatan positif dengan elektron yang mengelilingi dalam lintasannya. Pada teori struktur atom Bohr menunjukkan bahwa atom terdiri dari beberapa kulit.
Kulit ini adalah tempat berpindahnya elektron. Setelah abad ke-20, teori struktur atom modern atau model atom mekanika kuantum menyatakan atom terdiri dari inti atom bermuatan positif dan awan-awan elektron yang mengelilinginya.
Hingga saat ini, masih belum ada teori atau model mutlak dari sebuah atom. Pemahaman mengenai atom semakin berkembang, mengalami perbaikan dan penyempurnaan. Partikel dasar struktur atom berukuran sangat kecil hingga tidak bisa dilihat dengan mata telanjang.
Struktur atom ini ikut menentukan sifat dasar dari sebuah materi. Struktur atom berperan sebagai partikel penyusun sebuah materi. Maka, setiap unsur kimia yang berbeda akan memiliki jenis atom yang berbeda pula.
Sebaliknya, atom yang berasal dari benda yang sama akan memiliki sifat dan partikel dasar yang sama. Meskipun dikatakan sebagai bagian terkecil dari sebuah atom, struktur atom masih disusun oleh beberapa partikel subatomik.
Partikel subatomik menjadi penyusun dasar dalam atom yang terdiri dari proton, elektron, dan neutron.
Struktur Atom dan Sistem Periodik Unsur
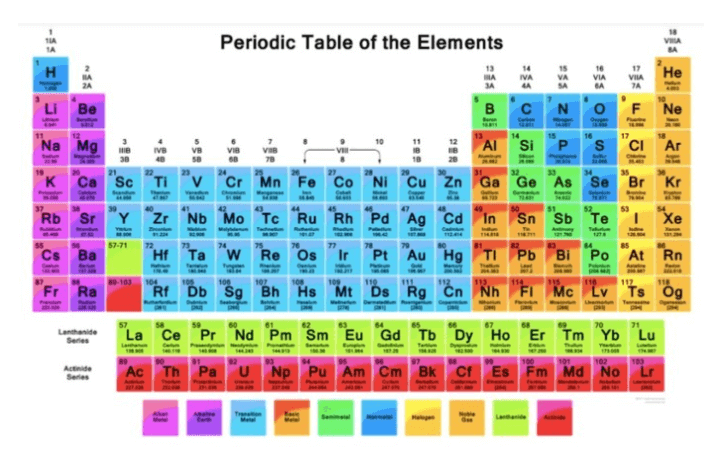
Tabel periodik adalah tabel yang menampilkan setiap unsur kimia dalam setiap sistemnya. Unsur-unsur kimia tersebut memiliki jumlah yang sangat banyak, dengan sifat yang berbeda-beda, antara satu dengan unsur yang lainnya. Tujuan dibuatnya tabel periodik unsur adalah untuk mengenal nama unsur dari partikel kimia secara mudah melalui pengelompokan.
Sistem periodik juga diartikan sebagai susunan yang menampilkan berbagai unsur kimia berdasarkan nomor atom dan kesamaan sifat kimianya.
Dalam pengelompokan tabel periodik, sifat fisik dan sifat kimia dari setiap unsur-unsur tersebut telah dituangkan oleh para ahli kimia dalam bentuk tabel unsur.
Adapun fungsi tabel periodik unsur adalah untuk membantu mengetahui nomor atom, konfigurasi elektron, dan mempelajari setiap sifat-sifat unsur serta keteraturannya. Pada tabel sistem periodik, akan ditemukan golongan dan periode di suatu lajur.
Golongan adalah lajur tegak atau baris vertikal pada sistem periodik. Sedangkan, periode adalah lajur mendatar atau baris horizontal.
Sifat Keteraturan Tabel Periodik
Dalam tabel periodik, akan ditemukan angka-angka dengan keteraturan sifat unsur berdasarkan jari-jari atom, keelektronegatifan, energi ionisasi, logam dan non-logam dan juga afinitas elektron.
Untuk bisa membaca dan memahami tabel periodik, ada baiknya kamu memperhatikan istilah-istilah di bawah ini.
- Jari-jari atom
Jari-jari atom adalah jarak dari inti atom sampai kulit terluar suatu atom. Secara periodik, jari-jari atom akan cenderung semakin besar dalam satu golongan dari atas ke bawah. Hal itu disebabkan karena bertambahnya nomor atom beserta kulit elektron dalam satu golongan.
Dalam satu periode, dari kiri ke kanan jari-jari atom cenderung semakin kecil, sebagaimana muatan inti efektif. Bertambahnya jumlah proton dalam muatan inti efektifnya, makin besar pula gaya tarik inti terhadap elektron terluar.
- Energi Ionisasi
Ionisasi merupakan energi untuk melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam wujud gas. Secara periodik, dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah.
Energi ionisasi bergantung pada elektron yang akan dilepaskan, yakni besar gaya tarik inti terhadap elektron kulit terluar.
- Afinitas Elektron
Besarnya energi yang dihasilkan atau dilepaskan pada suatu atom yang menarik sebuah elektron disebut afinitas elektron.
Secara periodik, dalam satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang (semakin kecil) dari kiri ke kanan sampai golongan VII A, dan cenderung bertambah (semakin besar) kecuali unsur alkali tanah dan gas mulia.
Semua unsur golongan utama mempunyai afinitas elektron bertanda negatif, di mana unsur golongan terbesarnya dimiliki oleh golongan halogen. Semakin negatif nilai afinitas elektron, maka semakin besar kecenderungan atom atau ion menerima elektron (afinitas terhadap elektron semakin besar).
- Elektronegativitas
Elektronegativitas atau keelektronegatifan merupakan kecenderungan suatu atom menarik pasangan elektron dalam membentuk ikatan. Unsur yang memiliki energi ionisasi dan afinitas elektron yang besar, akan membuat keelektronegatifan semakin besar.
Secara periodik, dalam satu golongan, dari atas ke bawah, elektronegativitas cenderung akan semakin kecil, sedangkan dari kiri ke kanan dalam satu periode, cenderung semakin besar sehingga membuat penarikan atom akan semakin mudah. Harga keelektronegatifan dapat diukur dengan skala Pauling, antara 0,7 (Fr) – 4,0 (Fr).
- Logam dan Non-logam
Sifat logam dan non logam merupakan kecenderungan atom untuk melepas elektron dan membentuk ion bermuatan positif (tergantung dengan energi ionisasi).
Sifat logam berkaitan dengan keelektropositifan. Semakin besar energi ionisasinya, maka sifat logamnya akan berkurang, karena sulit melepas elektron. Sementara itu, sifat non logam berkaitan dengan keelektronegatifan, yakni kecenderungan atom untuk menyerap elektron.
Kecenderungannya melepas atau menarik suatu elektron disebut dengan kereaktifan. Unsur logam yang paling reaktif adalah golongan IA.
Unsur non-logam paling reaktif berada pada golongan VIIA (lihat sifat logam dan non logam), di mana golongan VIIIA (gas mulia) tidak reaktif.
Secara periodik dalam satu golongan dari atas ke bawah kecil, dan dalam satu periode dari kiri ke kanan mula-mula menurun, dan akan bertambah hingga golongan VIIA.
Struktur Atom Karbon
Kekhasan atom karbon
- Atom karbon mempunyai nomor atom 6, dengan empat elektron valensi. Keempat elektron valensi membentuk pasangan elektron bersama dengan atom lain membentuk ikatan kovalen. Keempat elektron valensi ini dapat digambarkan sebagai tangan ikatan.
- Empat ikatan tangan yang dimiliki atom karbon dapat membentuk rantai dengan berbagai bentuk dan kemungkinan. Setiap kemungkinan menghasilkan satu jenis senyawa. Semakin banyak kemungkinan, semakin banyak jenis senyawa yang bisa dibentuk oleh atom karbon.
Beberapa kemungkinan rantai karbon yang dibentuk dapat dikelompokan berdasarkan:
- Jumlah ikatan
-
- Ikatan tunggal, yaitu ikatan antara atom-atom karbon dengan satu tangan ikatan (sepasang elektron ikatan).
- Ikatan rangkap dua, yaitu terdapat ikatan antara atom – atom karbon dengan dua tangan ikatan (dua pasang elektron ikatan).
- Ikatan rangkap tiga (ganda tiga), yaitu ikatan antara atom – atom karbon dengan tiga tangan ikatan (tiga pasang elektron ikatan).
- Bentuk rantai
-
- Rantai terbuka (alifatis), yaitu rantai yang antar ujung-ujung atom karbonnya tidak saling berhubungan. Rantai jenis ini ada yang bercabang dan ada yang tidak bercabang.
- Rantai tertutup (siklis), yaitu rantai yang terdapat pertemuan antara ujung–ujung rantai karbonnya. Terdapat dua macam rantai siklis, yaitu rantai siklis dan aromatis.
Demikianlah penjelasan terkait struktur atom. Semoga bisa menambah wawasan kita semua mengenai materi ini, terima kasih.